NA代表阿伏加德罗常数,下列说法正确的是( )
| A.0.5 mol Al与足量盐酸反应转移电子数为1NA |
| B.标准状况下,11.2 L SO3所含的分子数为0.5 NA |
| C.0.1 mol CH4所含的电子数为1NA |
| D.46 g NO2和N2O4的混合物含有的分子数为1NA |
已知反应:2SO2(g)+ O2(g)  2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所
示。则下列说法正确的是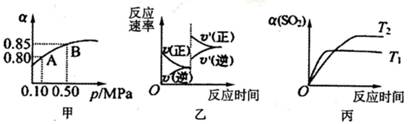
| A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1 |
| B.由图甲推断,A点对应温度下的平衡常数为80 |
| C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>Tl |
25℃时,0.1mol·L-1CH3COONa溶液pH=a,则
| A.该温度下,CH3COOH的Ka=1014-2a |
| B.该温度下,上述溶液中水的电离度α=(1.8×l0 a -14)% |
| C.升高温度,溶液中c(H+)增大,水解平衡常数K也增大 |
| D.加水稀释,CH3COONa水解程度增大,C(OH-)增大 |
下图是一种综合处理SO2废气的工艺流程。下列说法正确的是
| A.向B溶液中滴加KSCN溶液,溶液变为血红色 |
| B.溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2=2Fe3++2H2O |
| C.溶液酸性A>B>C |
| D.加氧化亚铁可以使溶液C转化为溶液A |
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是
| A.气态氢化物稳定性:R>Q |
B.元素T的离子结构示意图为 |
| C.与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 |
| D.Q可形成多种含氧酸 |
用下图所示装置不能达到有关实验目的是
| A.用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水) |
| B.用乙图装置制备Fe(OH) 2 |
| C.用丙图装置制取金属锰 |
| D.用丁图装置比较NaHCO3和Na2 CO3的热稳定性 |