取一支小试管,向其中加入过氧化钠固体,然后加入少量蒸馏水,将带余烬的小木条插入试管中,观察到的现象是____________________________,反应后,向其中滴入酚酞溶液,观察到的现象是___________________。该反应的化学方程式为
_____________________________。
(12分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为C6H6的结构有多种,其中的两种为:
①这两种结构的区别表现在定性方面(即化学性质方面):Ⅱ能_____(填入编号,下同),而Ⅰ不能_____。
A.被酸性高锰酸钾溶液氧化 B.与溴水发生加成反应
C.与溴发生取代反应 D.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成,Ⅰ需_____mol,而Ⅱ需_______mol。
②今发现C6H6还可能有另一种如图所示的立体结构,该结构的二氯代物有___________种。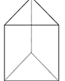
(2)已知萘的结构简式为 ,该结构简式不能解释萘的下列_______事实(填编号)。
,该结构简式不能解释萘的下列_______事实(填编号)。
A.萘不能使酸性高锰酸钾溶液褪色
B.萘能与H2发生加成反应
C.萘分子中所有原子在同一平面上
D.一溴代萘(C10H7Br)只有两种同分异构体
(6分)“立方烷”是合成的一种烃,其分子为正方体结构,其碳骨架结构如图A所示,则: 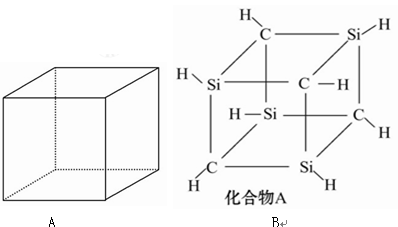
(1)写出立方烷的分子式__________。
(2)其二氯代物有____________种同分异构体。
(3)已知化合物A(C4Si4H8)与立方烷的分子结构相似,如图B所示,则C4Si4H8的二氯代物的同分异构体数目为________。
(10分)按分子结构决定性质的观点可推断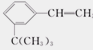 有如下性质:
有如下性质:
(1)苯环部分可发生______反应和__________反应;
(2)—CH=CH2部分可发生_______反应和_______反应;
(3)该有机物滴入溴水后生成产物的结构简式为_____。
(4分)(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为________。
(10分)有下列各组物质:
| A.O2和O3; | B.23592U和23892U; |
C.CH3CH2CH2CH3和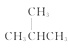 ; ; |
|
D.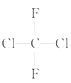 和 和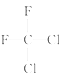 ; (E)甲烷和新戊烷 ; (E)甲烷和新戊烷 |
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体;
(5)__________组两物质互为同一物质。