1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2 2NH3,有关说法正确的是( )
2NH3,有关说法正确的是( )
| A.不同的催化剂对化学反应速率影响均相同 |
| B.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 |
| C.新法合成能在常温下进行是因为不需要断裂化学键 |
| D.哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
常温下,下列各组离子可能大量共存的是 ( )
| A.pH=7的溶液:Fe3+、NH4+、Cl-、NO3- |
| B.pH=2的溶液:Fe2+、Al3+、Cl-、NO3- |
| C.能使甲基橙显黄色的溶液:Cl-、CO32-、K+、AlO2- |
| D.与铝反应产生大量氢气的溶液:[Ag(NH3)2]+、Na+、CH3COO-、NH4+ |
提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 被提纯的物质 |
除杂试剂 |
分离方法 |
|
| A |
乙酸乙酯(乙酸) |
CCl4 |
萃取、分液 |
| B |
乙烷(乙烯) |
酸性KMnO4溶液 |
洗气 |
| C |
溴苯(溴) |
氢氧化钠溶液 |
分液 |
| D |
苯(苯酚) |
浓溴水 |
过滤 |
某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )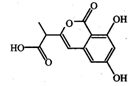
| A.1mol该有机物最多可以和5mol NaOH反应 |
| B.该有机物容易发生加成、取代、中和、消去等反应 |
| C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
| D.1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
| B.1mol甲基(-CH3)所含的电子总数为9NA |
| C.0.5mol 1, 3-丁二烯分子中含有碳碳双键数为NA |
| D.1 mol氯气溶于水发生反应转移电子的物质的量小于1mol |
分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A.1种 B.2种 C.3种 D.4种