设C+CO2 2CO正反应为吸热反应,反应速率为v1;N2+3H22NH3,正反应为放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
2CO正反应为吸热反应,反应速率为v1;N2+3H22NH3,正反应为放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
| A.同时增大 |
| B.同时减小 |
| C.v1增大,v2减小 |
| D.v1减小,v2增大 |
【改编】短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Z的原子序数是Y原子序数的2倍。下列说法错误的是
| A.四种元素中最简单气态氢化物稳定性最强的是Y |
| B.W元素形成的单质在空气中燃烧可以生成两种氧化物 |
| C.Z的氧化物是将太阳能转化为电能的常用材料 |
| D.X、Y、W的原子均能与氢原子形成18电子分子 |
下列所陈述的事实与解释均正确的是
| 选项 |
事实 |
解释 |
| A |
用pH试纸测出新制氯水的pH为3 |
新制氯水有酸性 |
| B |
SO2通入BaCl2溶液无明显现象 |
不符合离子反应的条件 |
| C |
收集铜与浓硝酸反应生成的气体,用补水混合物冷却降温,气体颜色变浅 |
生成的红棕色NO2气体部分转化为无色气体 |
| D |
甲苯能使酸性高锰酸钾溶液褪色 |
发生了萃取 |
【改编】25℃时,0.1mol/LNa2CO3溶液pH=12,下列判断正确的是
A.通入少量HCl气体后溶液中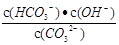 增大 增大 |
| B.升高温度溶液中c(OH-)和c(CO32-)均增大 |
| C.2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.c(HCO3-)+c(H+)+2c(H2CO3)=0.01mol/L |
某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是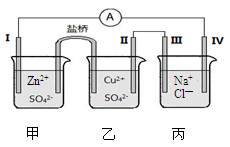
| A.电子由电极IV通过外电路流向电极I |
| B.装置工作过程中III电极周围出现红色 |
| C.电极II发生还原反应 |
| D.盐桥中Cl—向乙池移动 |
【原创】NA表示阿伏加德罗常数,下列叙述中正确的是
| A.室温下,31.0g白磷中含有的共价键数目为NA |
| B.3.6g过氧化钙(CaO2)固体中阴、阳离子总数约为0.1NA |
| C.60gSiO2中含有NA个SiO2分子 |
| D.1molFel2与足量氯气反应时转移的电子数为2NA |