一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )

| A.反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1 |
| C.反应开始到10 s时,Y的转化率为79.0% |
| D.反应的化学方程式为:X(g)+Y(g)====Z(g) |
对于可逆反应: 2A(g)+B(g) 
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是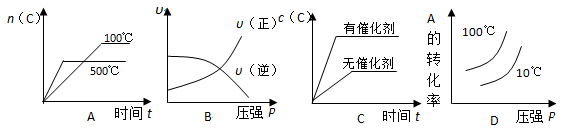
在密闭容器中,反应X2(g)+Y2(g)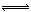 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
| A.图Ⅰ是加入适当催化剂的变化情况 | B.图Ⅱ是扩大容器体积的变化情况 |
| C.图Ⅲ是升高温度的变化情况 | D.图Ⅲ是增大压强的变化情况 |
下列图示中关于铜电极的连接错误的是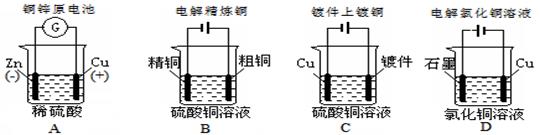
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为: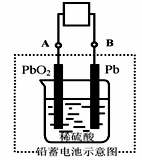
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,则下列说法正确的是:
2PbSO4+2H2O,则下列说法正确的是:
| A.放电时:电子流动方向由A到B |
B.放电时:正极反应是Pb-2e-+SO42- PbSO4 PbSO4 |
| C.充电时:铅蓄电池的负极应与充电器电源的正极相连 |
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+ PbO2+SO42-+4H+ |
右图是模拟电化学反应的装置图。下列有关叙述中,不正确的是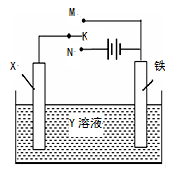
| A.X为铜棒,Y为CuSO4溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| B.X为铜棒,Y为CuSO4溶液,开关K置于N处,铁棒质量将增加,溶液中Cu2+浓度将减小 |
| C.X为碳棒,Y为NaCl溶液,开关K置于N处,溶液中的阳离子向铁电极移动 |
| D.X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |