从实验测得不同物质中O—O之间的键长和键能的数据为:
| O—O键 数据 |
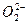 |
 |
O2 |
 |
| 键长/10-12m |
149 |
128 |
121 |
112 |
| 键能/kJ·mol-1 |
x |
y |
z=494 |
w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
| A.成键时电子数越多,键能越大 | B.键长越长,键能越大 |
| C.成键所用的电子数越少,键能越大 | D.成键时电子对越偏移,键能越大 |
下列制取气体的方案,可以直接采用如图所示装置进行的有( )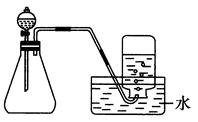
①用H2O2和MnO2制取O2
②用CaCO3和稀盐酸制取CO2
③用KClO3和MnO2制取O2
④用Zn和稀H2SO4制取H2
⑤用Cu和浓HNO3制取NO2
| A.①④ | B.①②④ | C.①②⑤ | D.①②④⑤ |
下列装置能达到实验目的的是( )
| A.除去乙醇中的苯酚 | B.制取金属锰 |
| C.实验室制氨气 | D.从碘的CCl4溶液中分离I2 |
下列关于元素周期表和元素周期律的说法错误的是()
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐增强 |
| C.因为Na比K容易失去电子,所以Na比K的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
运用元素周期律分析下面的判断,其中错误的是()
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为白色固体,HAt不稳定,AgAt感光性很强 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)无色、有毒,比H2S更不稳定 |
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述正确的是()
| A.常压下五种元素的单质中Z单质的沸点最低 |
| B.Y、Z阴离子电子层结构都与R原子相同 |
| C.W的原子半径比X的小 |
| D.Y元素的非金属性比W元素的非金属性强 |