在密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g)
 N2(g)+CO2(g)
N2(g)+CO2(g)
ΔH="-373.2" kJ/mol
达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是()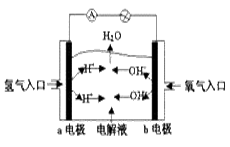
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-==2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置 |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确的是()
| A.正极反应式为:O2 + 2H2O + 4e- = 4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需更换铝板就可继续使用 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()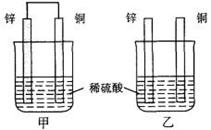
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 | D.产生气泡的速度甲比乙慢 |
下图各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)()
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ/mol、243kJ/mol和431kJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为()
| A.放热91.5kJ | B.放热183kJ | C.吸热183kJ | D.吸热91.5kJ |