将甲、乙两种有机物组成的混合物进行分离,已知甲、乙的某些性质如下:
| 物质 |
密度/g·mL-1 |
沸点 |
水溶性 |
溶解性 |
| 甲 |
0.893 |
78.5 ℃ |
溶 |
溶于乙 |
| 乙 |
1.220 |
100.7 ℃ |
溶 |
溶于甲 |
则应采取的分离方法是( )
| A.蒸馏 | B.干馏 | C.分液 | D.过滤 |
下列各组离子在指定条件下,一定能大量共存的是
| A.pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- |
| B.能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- |
| C.在含大量Fe3+ 的溶液中:NH4+、Na+、Cl-、NO3- |
| D.能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- |
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
| A.①②③均是氧化还原反应 |
| B.氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2 |
| C.反应②中氧化剂与还原剂的物质的量之比为6:1 |
| D.反应③中0.1mol还原剂共失去电子数为6.02×1023 |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
 物质 物质组别 |
甲 |
乙 |
丙 |
| A |
Mg |
FeSO4 |
O2 |
| B |
Al2O3 |
HCl |
NaOH |
| C |
CO2 |
H2O |
Na2O2 |
| D |
NaHCO3 |
Ca(OH)2 |
Na2CO3 |
下列表示对应化学反应的离子方程式正确的是
| A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
C.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+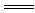 Ca2++2H2O+2CO2↑ Ca2++2H2O+2CO2↑ |
| D.强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3= FeO42-+3Cl-+H2O+4H+ |
硅及其化合物的应用范围很广。下列说法正确的是
| A.硅是人类将太阳能转换为电能的常用材料 |
| B.粗硅制备单晶硅不涉及氧化还原反应 |
| C.水泥、水晶和餐桌上的瓷盘都是硅酸盐制品 |
| D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |