(1)图(Ⅰ)中瓶a内放入20 mL 6 mol·L-1盐酸,b是充气的气球,里边放有4 g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹将d夹紧(瓶口和侧口都不漏气)。将图(Ⅰ)的装置放在托盘天平上称量,质量为W1。根据实验现象填写下列空白:
(1)把气球b中碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ)。反应结束后,再次称量,质量为W2。则W1和W2的关系是___________。
(2)取25 mL 6 mol·L-1NaOH溶液,先用滴管取少量NaOH溶液,滴管插入胶管c口(为方便操作,可以适当倾斜瓶a,注意防止漏气)。打开d,将溶液挤入瓶中,立即夹紧d,可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失。使沉淀消失的反应的化学方程式是________________________________________________________________。
(3)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解,此时瓶内温度___________(填“不变”“降低”或“升高”)。
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状。写出这时发生的反应的化学方程式:____________________________;____________________________。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。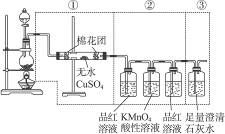
(1)如图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质是__________;不能检验出的物质是__________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是__________;不能检验出的物质是__________。
(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是__________;不能检验出的物质是__________。
为验证木炭可被浓硫酸氧化成二氧化碳,选用下图中仪器(含所盛物质)组装成套实验装置,试完成下列问题。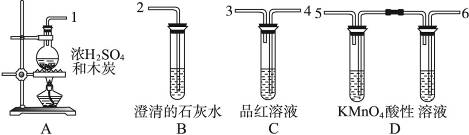
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应该是____________接____________,____________接____________,____________接____________。
(2)试管B、C中各有什么现象,才能表示已检出二氧化碳?
B中_________________________________,C中__________________________________。
(3)试管D中能否用饱和NaHCO3溶液代替KMnO4酸性溶液?说明理由。
Ⅰ.将氯水滴到蓝色石蕊试纸上,现象是____________;将H2SO4(aq)滴到蓝色石蕊试纸上,现象是____________;将浓H2SO4滴到湿润的蓝色石蕊试纸上,现象是____________。
Ⅱ.设计实验:只用BaCl2溶液作试剂鉴别Na2SO3溶液和H2SO4稀溶液。要求:只写出实验方法、现象和结论。
A、B两课外活动小组欲从废CuO中回收Cu,实验室提供了Zn和稀H2SO4两种原料,两小组分别设计了自己的实验方案:
你认为A组方案_____________(填“优于”或“劣于”)B组方案,原因是__________________________。
设计一个只用BaCl2溶液及试管鉴别Na2SO3溶液和稀硫酸的实验,简要写出鉴别过程。