(经典回放)
阅读下列短文,完成问题:
汽车作为曾经推动人类文明向前跃进的现代社会的产物,在给人类的生活带来便捷舒适的同时,对自然生态环境的恶化也有难以推卸的责任。据6月15日我市政府发布的“2000年厦门环境状况公报”称:厦门大气污染主要来源于工业污染和汽车尾气,99%的一氧化碳和一氧化氮的排放来源于汽车尾气。我市近几年来汽车持有量的增长达20%,虽然空气质量居全国第四,但环保仍面临如汽车污染等问题的考验。
另据报道:将氢气应用于汽车发动机的技术已在我国研制成功;酒精作为燃料的汽车已在北京市、河南省使用;我市也有一部分汽车改用液化气作为燃料。
(1)汽车尾气中的大气污染物有(写化学式)____________,____________。
(2)我市将部分汽车排气管加装三效转换器,促使一氧化碳在排气管内与空气作用转化为二氧化碳,其反应式为
____________________________________________________________。
(3)请提出我市治理汽车污染的一条合理化建议:
____________________________________。
(4)就目前的情况看,氢气做燃料的汽车要投入使用前,你认为还要研究解决的问题有:_____________________________________________________________________________。
(5)若实验用氢气汽车运行1 km,需要2 858 kJ能量。现这辆汽车在我市环岛路上走一圈(约30 km),需要____________g氢气。(已知每克氢气燃烧放出142.9 kJ能量。)
已知一氧化碳与水蒸气的反应为
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,
我们跟踪测定H2O的物质的量浓度,
如图所示: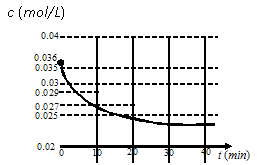
则0~20min的反应速率是从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为_____________(填“放热反应”或“吸热反应”或“不能确定”)。
求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
一定温度下,在密闭容器中,发生反应: 2NO2 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度?;
(2)此时NO2的转化率?。
充分加热碳酸钠和碳酸氢钠的混合物19g,完全反应后固体质量减轻了3.1g,求:
(1)原混合物中碳酸钠的质量。
(2)将原混合物溶于水配成300mL溶液,其中C(Na+)等于多少?
(3)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)。
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取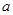 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为
g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为 L。反应的化学方程式是_________________。样品中铝的质量是____________g。
L。反应的化学方程式是_________________。样品中铝的质量是____________g。
2)若取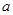 g样品在高温下将其恰好完全反应,该反应的化学方程式是:__________________,氧化铁和铝的质量比是____________。
g样品在高温下将其恰好完全反应,该反应的化学方程式是:__________________,氧化铁和铝的质量比是____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体积为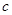 L,该气体与(1)中所得气体的体积比
L,该气体与(1)中所得气体的体积比 =_________。
=_________。
在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L,
求:
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。