下列规律错误的是( )
| A.离子半径:F-<Cl-<Br-<I- |
| B.稳定性:HI >HBr>HCl>HF |
| C.还原性:HI>HBr>HCl>HF |
| D.氧化性:F2>Cl2>Br2>I2 |
下列有关实验的操作、原理和现象的叙述正确的是
| A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| C.为观察Mg条在CO2中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚夹持点燃后迅速投入上述集气瓶底部 |
| D.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值 |
下列说法不正确的是
| A.用石灰石或石灰乳进行燃煤烟气脱硫(除SO2)可获得副产品石膏 |
| B.金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法 |
| C.若在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 |
| D.常温时,某可逆反应的平衡常数越大则其反应速率越快 |
如下图所示,在毛玻璃片上放有一张浸有KI淀粉溶液的含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液)。有关说法正确的是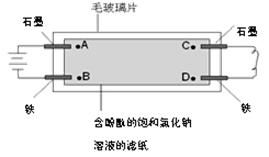
A.A点比B点先出现红色B.B点比A点先出现红色
C.B点附近的溶液变为蓝色 D.D点附近的溶液变为蓝色
下列有关实验正确的是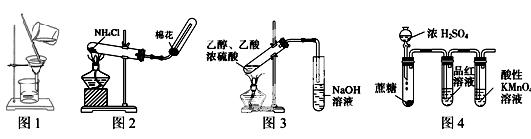
| A.图1:可用于分离乙醇和水 |
| B.图2:实验室制备氨气 |
| C.图3:实验室制备乙酸乙酯 |
| D.图4:检验浓硫酸与蔗糖反应产生的二氧化硫 |
常温下,pH=11的X、Y两种碱溶液各10 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是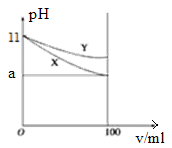
| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积V(X)<V(Y) |
| D.若a=10,则X、Y都是弱碱 |