A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数是次外层的两倍;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:

请完成下列问题:
(1)化合物己的电子式:________________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为______mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为____________。
(4)F的单质与甲反应的离子方程式为_______________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为___________。
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C―比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)A元素的名称是_______;
(2)C―的结构示意图为;D元素在周期表中的位置是__________;
(3)元素D的气态氢化物的电子式为____,其分子的结构特点是具有_____结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是_______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为_____________________________________;
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式_______,若反应中有0.25mol氧化铁参加反应反应中转移电子的个数为__________;
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材
料是_______(用化学式填写),负极电极反应是___________________________________。
现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。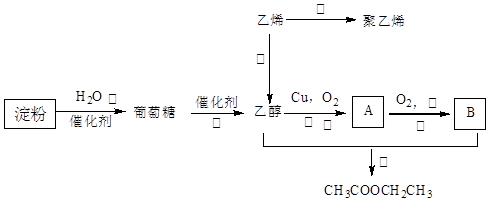
(1)A中含有的官能团名称是;其中⑥的反应类型是;
(2)写出下列反应的化学方程式:①
③
⑤
(3)另一同学用葡萄糖和冰醋酸反应,若C6H12O6与CH3COOH的分子个数比为1:1,则生成的有机物可能有种。请任写一种产物的结构简式:。
(4)用乙酸乙酯和H218O反应制取乙醇时原子的最大利用率为
(10分)某离子晶体的晶胞结构如图所示,试求:
(1)晶体中每一个Y同时吸引着______个X,每个X同时吸引着________个Y,该晶体的化学式是________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______个。
(3)设该晶体的摩尔质量为M g·mol-1,晶胞密度为ρ g·cm-3,阿伏加德罗常数为NA·mol-1,则晶体中两个最近的X中心间距离为________ cm。
(14分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1) 上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Cu原子的核外电子排布式_____
(2) 根据等电子原理,写出CO分子的结构式_______________。
(3) 甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________。
(8分)填写下列空白(填序号):
①CH4 ②CH2==CH2 ③CH CH④NH3 ⑤NH4+⑥BF3 ⑦P4
CH④NH3 ⑤NH4+⑥BF3 ⑦P4
⑧H2O ⑨H2O2⑩ SO2⑾PCl3⑿SO3⒀HCHO⒁CO2
(1) 呈正四面体的是________。
(2) 属于极性分子且中心原子轨道为sp3杂化的是__________________________,
属于非极性分子且中心原子轨道为sp2杂化的是___________,为sp杂化的是________。
(3) 所有原子共平面的是______________,共线的是______________。
(4) 微粒存在配位键的是________。(5)含有极性键的极性分子是________。