短周期元素X和Y,可组成化合物XY3,当X的原子序数为m,Y的原子序数可能是( )
①m+4 ②m-4 ③m-8 ④m+2⑤m-6 ⑥m+12
| A.①②③ | B.①④⑤⑥ | C.①②③④⑤ | D.①②③④⑤⑥ |
除去下列括号内杂质的试剂和方法错误的是
| A.HNO3溶液(H2SO4):适量BaCl2溶液,过滤 |
| B.CO2(SO2):酸性KMnO4溶液、浓硫酸,洗气 |
| C.KNO3晶体(NaCl):蒸馏水,重结晶 |
| D.C2H5OH(CH3COOH):加足量CaO,蒸馏 |
某高分子材料的结构如图所示: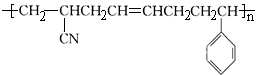
以下与此高分子材料相关的说法正确的是
| A.合成该高分子材料的反应是缩聚反应 |
| B.该高分子材料是由三种单体聚合而成的 |
| C.合成该高分子材料的部分单体不能使溴水和酸性高锰酸钾溶液褪色 |
| D.该高分子材料是体型结构高分子,具有热固性 |
下列文字表述与反应方程式对应正确的是
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+ Ag+ = AgBr↓ |
| B.用醋酸除去水垢:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |
C.实验室用液溴和苯在催化剂作用下制溴苯: |
| D.硝酸银溶液中滴加过量氨水:Ag+ + NH3·H2O =" AgOH↓+" NH4+ |
苯酚分子结构中化学键如图所示,关于苯酚在各种反应中断键的说明不正确的是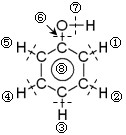
| A.和氢气发生加成时大π键⑧断裂 |
| B.和金属钠反应时键⑦断裂 |
| C.和饱和溴水反应时键①、③、⑤断裂 |
| D.制备酚醛树脂时键②、⑥断键 |
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
| A.利用金属钠或者金属钾 | B.利用质谱法 |
| C.利用红外光谱法 | D.利用核磁共振氢谱 |