A、B、C、D是四种短周期主族元素,其中B的原子序数最小,A、B同主族,C、D同主族,A比C的核外少两个电子;D元素一种原子的质量数是其质子数的两倍多2,又是该原子最外层电子数的3倍。判断A、B、C、D各是什么元素,并比较A、B、C三种元素的最高价氧化物对应的水化物溶液酸、碱性的相对强弱。
(1)A_____、B_____、C_____、D_____。(填元素符号)
(2) _____ (填酸性或碱性):_____>_____>_____。(填分子式)
下列关系中,A是一种正盐,D的分子量比C的分子量大16,E是酸;当X无论是强碱还是强酸时都有如下转化关系: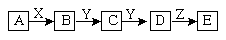
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强酸时,A、B、C、D、E均同时含有另一种元素。回答下列问题:(用化学式填写)
(1)A是_____________,Y是______________,Z是____________。
(2)当X是强碱时,写出B与Y反应的化学方程式:___________________________。
(3)当X是强酸时,写出C与Y反应的化学方程式:___________________________。
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO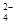 ,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:_________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:______________________、_________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式:____________。
(16分) 物质的量是高中化学中常用的物理量,请完成以下有关其内容的计算:
(1)标准状况下,含有相同氧原子数的CO与CO2的体积之比为______。
(2)等温等压下,等体积的O2和O3所含分子个数比为________ ,原子个数比为________ ,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g某气中含有的分子数为b,则c g某气在标准状况下的体积约是________。 (用含NA的式子表示).
(4)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为_______ mL.
(5)100 mL 某Al2(SO4)3溶液中,n(Al3+)=0.20 mol,则其中c(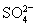 )= ______mol/L。
)= ______mol/L。
(6)某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数5.6%,300mL该溶液中Cl-的物质的量等于______ .
(14分)常用于分离和提纯的物理方法有:
A萃取分液法 B结晶法 C分液法 D蒸馏法 E过滤法
(1)选择实验方法分离下列物质,将分离方法(填字母)填在横线上
①________分离饱和食盐水与沙子的混合物。
②________分离水和汽油的混合物。
③________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
④________从碘的水溶液里提取碘。
⑤________从硝酸钾和氯化钠的混合液中获得硝酸钾。
(2)分离②和④时均使用的一种仪器在另三种实验方法中无需使用,这种仪器是_______。
(3)上述五种实验方法中,需使用酒精灯的有________(填数字编号)。
牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为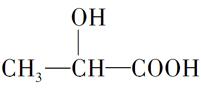 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:______、______。
(2)写出乳酸与足量金属钠反应的化学方程式:
_____________________________________________________。
(3)写出乳酸与碳酸钠溶液反应的化学方程式:
_____________________________________________________。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此生成物的结构简式:
_________________________________。