下列离子方程式书写正确的是( )
| A.金属铁溶于稀盐酸2Fe+6H+====2Fe3++3H2↑ |
| B.用NaOH对Cl2进行尾气回收Cl2+2OH-====Cl-+ClO-+H2O |
| C.Cl2溶于水Cl2+H2O====2H++Cl-+ClO- |
| D.碘化钾中滴入溴水Br2+2I-====I2+2Br- |
化合物A在一定条件下发生分解反应,反应物浓度随反应时间的变化如图所示。则化合物A在4~8min间的平均反应速率为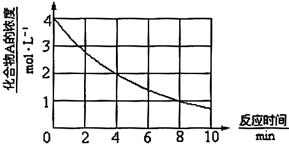
A.0.20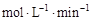 |
B.0.25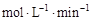 |
C.0.30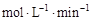 |
D.0.50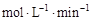 |
下列离子方程式正确的是
A.Zn与稀H2SO4反应:Zn+H+ Zn2++H2↑ Zn2++H2↑ |
B.Na2CO3溶液与足量盐酸反应: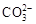 +2H+ +2H+ H2O+CO2↑ H2O+CO2↑ |
C.Cl2与NaOH溶液反应:Cl2+2OH― 2Cl―+H2O 2Cl―+H2O |
D.MgC12溶液与过量氨水反应:Mg2++2OH- Mg(OH)2↓ Mg(OH)2↓ |
下列各组离子能在溶液中大量共存的是
A.K+、H+、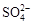 、OH― 、OH― |
B.Na+、H+、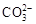 、Cl- 、Cl- |
C.Na+、Ca2+、 、 、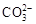 |
D.Na+、K+、Cl―、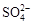 |
在25℃,101 k Pa下,0.2 mol C2H2完全燃烧生成CO2和H2O(l)时放出259.92 kJ热量。表示上述反应的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=+259.92 kJ/mol |
| B.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-259.92 kJ/mol |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2599.2 kJ/mol |
下列物质的水溶液呈酸性的是
| A.K2SO4 | B.NaHSO4 | C.Na2SiO3 | D.NH3 |