科学界拟合成一种“双重结构”的球形分子,即把足球烯C60分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列有关叙述正确的是()
| A.该反应属于置换反应 |
| B.该晶体属于原子晶体 |
| C.该物质具有极高的熔沸点 |
| D.该物质是一种新型化合物 |
下图是恒温下化学反应“A(g)+B(g)  C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是()
C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是()
| A.平衡态Ⅰ与平衡态Ⅱ的正反应速率相等 |
| B.平衡移动的原因可能是增大了反应物浓度 |
| C.平衡移动的原因可能是增大了压强 |
| D.平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1<K2 |
用水稀释0.1 mol/L氨水时,溶液中随水量的增加而增大的是()
| A.c(H+)和c(OH-)的乘积 | B.c(NH3·H2O)/c(OH-) |
| C.c(NH4+)/c(NH3·H2O) | D.pH值 |
一定条件下,对于可逆反应X(g)+3Y(g)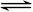 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不正确的是( )
A.c1∶c2=1 ∶3 ∶3 |
B.该反应一定是朝正向反应建立平衡 |
| C.X、Y的转化率相等 | D.c1的取值范围为0<c1<0.14 mol/L |
已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2=-393.5KJ/mol(3) H2(g)+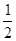 O2(g)=H2O(l) △H3="-285.8KJ/mol"
O2(g)=H2O(l) △H3="-285.8KJ/mol"
试计算下列反应的焓变:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=()
| A.-488.3 KJ/mol | B.+488.3KJ/mol |
| C.-245.7KJ/mol | D.+245.7KJ/mol |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)=2Z(g)+W(s)ΔH<0,下列叙述正确的是()
| A.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| B.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
| C.达到平衡时,反应速率v正(X)=2v逆(Z) |
| D.平衡常数K值越大,X的转化率越大 |