图4-38中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状态)气体。回答: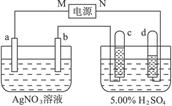
图4-38
(1)直流电源中,M__________为极。
(2)Pt电极上生成的物质是________,其质量为________g。
(3)电源输出的电子,其物质的量与b、c、d各电极分别生成的物质的物质的量之比为:_________∶________∶________∶________。
(4)AgNO3溶液的浓度_______,AgNO3溶液的pH________,H2SO4溶液的浓度______,H2SO4溶液的pH______(填增大、减小或不变)。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用在空气中向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到整个过程的实验现象是______________,②加入NaOH溶液后,反应过程中发生反应的化学方程式是______________________和__________________。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有Fe )。
)。
Ⅱ.SCN-的电子式为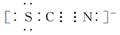
Ⅲ.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为Fe ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。
②第二种假设是:__________________________。
某实验小组利用如下仪器组装一套制备氮化硼晶体的装置。
反应原理是B2O3 + 2NH3 2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
(1)各仪器接口由左到右的连接顺序为。
(2)实验过程分为如下操作:①提纯BN ②滴加浓氨水③添加药品④连接装置
⑤加热管式电炉⑥检查装置气密性⑦取出反应混合物⑧停止加热,继续通一段时间的氨气。则正确的操作顺序为_______________________(填序号)。
(3)装置D的作用是。
(4)装置C能产生氨气的原因有(答出其中一项即可)。
(5)管式电炉加热反应前必须进行的一步操作是,反应结束时,继续通一段时间氨气的目的是。
(6)除去产物中未反应的B2O3并得到纯净的BN固体的实验操作是__________。
已知醋酸是日常生活中常见的弱酸。
(1)用pH试纸测定醋酸pH的操作是___________。
(2)常温下在 pH =5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是______ mol•L—1。
(3)用0.1000 mol•L—1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处(填序号)。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器___________________。
(4)某次滴定前滴定管液面如图所示,读数为________mL。

(5)根据正确实验结果所绘制的滴定曲线如上图所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离平衡常数___________,CH3COOH的物质的量浓度为__________ mol•L—1。
(12分)甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量Na2O)的纯度。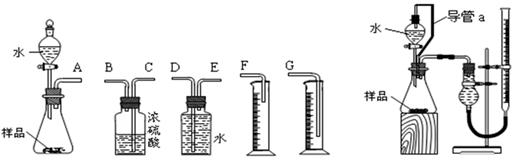
(1)甲组同学拟选用左图实验装置完成实验:
①写出实验中所发生反应的化学方程式_____________________________________________
②该组同学必须选用的装置的连接顺序是:A接()()接()()接()(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其旋塞,一会儿后水也不能顺利滴入锥形瓶。请你帮助分析原因: _____________________________________ __。
④实验结束时,该组同学应怎样测量实验中生成的氧气的体积?。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是:____________________________、_________。
②若实验中样品的质量为wg,实验前后碱式滴定管中液面读数分别为V1、V2 (换算成标况)。则样品的纯度为____________________________(含w、V的表达式)。
实验室配制500 mL 0.1 mol·L-1的Na2CO3溶液,请回答下列问题。
(1)应用托盘天平称取Na2CO3·10H2O晶体g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1 g以下用游码),天平平衡时,则实际称量的Na2CO3·10H2O晶体g。
(3)用托盘天平和小烧杯称出Na2CO3·10H2O的质量,其正确操作顺序的标号为(操作可以重复)_______________。
| A.调整零点 |
| B.将游码移至刻度尺的零刻度处,将砝码放回砝码盒内 |
| C.将碳酸钠晶体放入小烧杯中称量 |
| D.称量空的小烧杯 |
E.记录称量结果
(4)下列操作对配得的溶液无影响的是(填序号);会使所配溶液浓度偏大的是(填序号)。
①在烧杯内溶解溶质,搅拌时不慎溅出少量溶液。
②容量瓶未烘干就用来配制溶液。
③定容时俯视刻度线。
④定容时仰视刻度线。
⑤定容时不小心使少量蒸馏水流出瓶外。
⑥将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出。