下列有关操作或判断正确的是()
| A.配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 |
| B.用托盘天平称取25.20 g NaCl |
| C.用100 mL的量筒量取5.2 mL的盐酸 |
| D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高 |
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是()
A.溶质的质量分数w=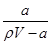 ×100% ×100% |
B.溶质的物质的量浓度c=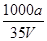 mol·L-1 mol·L-1 |
C.溶液中c(OH-)=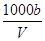 mol·L-1+c(H+) mol·L-1+c(H+) |
| D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w |
下列实验过程中的有关变化与对应的图形相符合的是()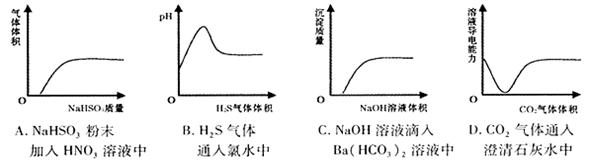
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物中n(NO2)∶n(NO)=1∶1时,下列说法正确的是()
| A.产物中n[Cu(NO3)2]∶n[CuSO4]=1∶1 |
| B.参加反应的n(Cu2S)∶n(HNO3)=1∶5 |
| C.反应中Cu2S既作氧化剂,又作还原剂 |
| D.1 mol Cu2S参加反应时有8 mol电子转移 |
下列各组物质的无色溶液,不用其它试剂即可鉴别的是()
①KOH Na2SO4 AlCl3②NaHCO3 Ba(OH)2 H2SO4
③HCI NaAlO2 NaHSO4④Ca(OH)2 Na2CO3 BaCl2
| A.①③④ | B.①②④ | C.①② | D.②③ |