在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高。由此判断下列各组金属熔沸点高低顺序,其中正确的是( )
| A.Mg>Al>Ca | B.Al>Na>Li |
| C.Al>Mg>Ca | D.Mg>Ba>Al |
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于8939Y的说法不正确的是()
| A.属于金属元素 |
| B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 |
| D.8939Y和9039Y是两种不同的核素 |
图表归纳是学习化学的一种常用方法,某同学表中归纳的内容与图K3-2对应正确的是( )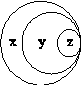
| 选项 |
x |
y |
z |
| A |
胶体 |
混合物 |
淀粉溶液 |
| B |
化合物 |
酸性氧化物 |
一氧化氮 |
| C |
纯净物 |
化合物 |
液溴 |
| D |
强电解质 |
强酸 |
硫酸 |
将0.195g锌粉加入到20mL 0.100 mol•L—1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
下列说法正确的是
| A.0.5mol SO2和11.2LCO2所含的分子数目一定相等 |
| B.25℃和100℃时,水的pH相等 |
| C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等 |
D.2SO2(g)+O2(g)  2SO3(g) 和4SO2(g)+2O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 4SO3(g)的△H相等 4SO3(g)的△H相等 |
25℃时对于pH=1的盐酸,下列叙述不正确的是
| A.c(H+)= c(Cl—)+ c(OH—) |
| B.c(H+)·c(OH—)=1.0×10—14 |
| C.由水电离出的c(H+)=1.0×10—13mol•L—1 |
| D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性 |