下图有关电化学的示意图正确的是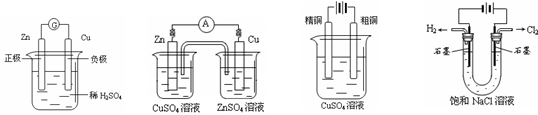
A. B. C. D.
某药品说明书中标明:本品每克含碘15mg,镁65mg,铜2mg,锌1.5mg,锰1mg,这里所标的各成分是()
| A.分子 | B.元素 | C.单质 | D.离子 |
下列图示对应的实验操作均正确的是( )
| A.向试管中加锌粒 | B.点燃另一酒精灯 | C.检查装置的气密性 | D.稀释浓 硫酸 硫酸 |
右图是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( )
| A.硫元素属于金属元素 |
| B.硫原子核内有16个质子 |
| C.硫的相对原子质量为16 |
| D.硫原子在化学反应中容易失去电子 |
若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
A Mn+2HCl==MnCl2+H2↑B Mg+MnSO4==MgSO4+Mn
C Mn+Cu(NO3)2==Mn(NO3)2+Cu D Fe+MnSO4==FeSO4+Mn
小林查阅资料获得有关物质燃烧的新信息:(1)2Na+C12点燃2 NaCl (2)2Mg+CO2点燃2MgO+C。由此形成以下几点认识: ①工业上常用反应(1)生产食盐②使用CO2灭火应有所选择③燃烧不一定要有氧气参与 ,其中有关认识正确的是 ( )
A.①② B.②③ C.①③ D.只有②