在一定条件下,下列粒子的还原性顺序为:
Cl-<Br-<Fe2+<I-<SO2,由此判断下列各反应在溶液中不能发生的是
A.2Fe3++SO2+2H2O====2Fe2++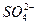 +4H+ +4H+ |
B.2Br-+4H++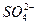 ====SO2+Br2+2H2O ====SO2+Br2+2H2O |
| C.2Fe2++Cl2====2Fe3++2Cl- |
D.I2+SO2+2H2O====4H++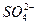 +2I- +2I- |
下列判断错误的是
| A.沸点: NH3> PH3> AsH3 | B.熔点: Si3N4> NaCl > SiI4 |
| C.酸性:HClO4> H2SO4> H3PO4 | D.碱性:NaOH > Mg(OH)2> Al(OH)3 |
设NA代表阿佛加德罗常数的数值,下列说法中正确的是
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2 NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05 NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气含有的核外电子数为2 NA
| A.①④⑤ | B.②③④ | C.②④⑥ | D.②⑤⑥ |
 已知X、Y元素同周期,且得电子能力X>Y,下列说法正确的是
已知X、Y元素同周期,且得电子能力X>Y,下列说法正确的是
| A.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 |
| B.在元素周期表中X位于Y的左面 |
| C.Y的气态氢化物的稳定性大于X的气态氢化物的稳定性 |
| D.X与Y形成的化合物中,X显负价,Y显正价 |
下列说法正确的是
| A.冰溶化时,分子中H-O键发生断裂 |
| B.原子晶体中,共价键越强,熔点越高 |
| C.分子晶体中,共价键键能越大,分子晶体的熔沸点越高 |
| D.分子晶体中,分子间作用力越大该物质越稳定 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
||||
| 原子半径/ | 160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+3、+5、-3 |
-2 |
下列叙述正确的是
| A. |
、 元素的金属性 < |
| B. |
一定条件下, 单质与 的常见单质直接生成 |
| C. |
的最高价氧化物对应的水化物能溶于稀氨水 |
| D. |
一定条件下, 单质可以将 单质从其氢化物中置换出来 |