把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
| A.是Fe3+和Cu2+ | B.是Fe2+和Cu2+ | C.是Fe3+和Fe2+ | D.只有Fe2+ |
将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是
| A.反应过程中不可能产生H2 |
| B.剩余的金属粉末中一定有铜 |
| C.往反应后的溶液中加入KSCN溶液会变血红色 |
| D.往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
用试纸检验气体性质是一种重要的实验方法。如下图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是
| 选项 |
试剂B |
湿润的试纸A |
现象 |
结论 |
| A |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
| B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气为碱性气体 |
| C |
Na2SO3,硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
| D |
Cu,浓硝酸 |
淀粉一KI试纸 |
变蓝 |
NO2为酸性气体 |
将4 mol A气体和2 mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 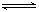 2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是
| A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 |
| B.2s时的压强是起始时的1.1倍 |
| C.2s时物质A的转化率为30% |
| D.2s时物质B的浓度为0.7 mol•L-1 |
图中曲线表示元素周期表前20号元素中的某些元素的原子序数(按递增顺序连续排列)及其常见最高化合价的关系,其中A点表示的元素是
| A.Si | B.Al | C.O | D.N |
在酸性溶液中,下列各组离子因发生氧化还原反应而不能大量共存的是
| A.Ag+、Ca2+、Cl-、CO32- | B.Cl-、SO42-、K+、Na+ |
C.Fe2+、Na+、K+、NO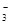 |
D.K+、Na+、Br-、AlO2- |