由FeO、Fe3O4和Fe2O3组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则该混合物中FeO、Fe3O4、Fe2O3的物质的量之比可能是( )
| A.1∶1∶2 | B.2∶1∶1 | C.1∶2∶2 | D.1∶3∶1 |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
| A.该反应的化学平衡常数表达式是K= |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol/L,c(H2O2)=0.400 mol/L时的反应速率为( )
| 实验编号 |
1 |
2 |
3 |
4 |
5 |
| c(HI)/(mol·L-1) |
0.100 |
0.200 |
0.300 |
0.100 |
0.100 |
| c(H2O2)/(mol·L-1) |
0.100 |
0.100 |
0.100 |
0.200 |
0.300 |
| v/(mol·L-1·s-1) |
0.00760 |
0.0153 |
0.0227 |
0.0151 |
0.0228 |
| A.0.0380 mol·L-1·s-1 | B.0.152 mol·L-1·s-1 |
| C.0.608 mol·L-1·s-1 | D.0.760 mol·L-1·s-1 |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):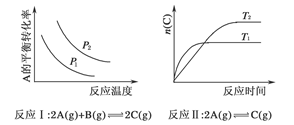
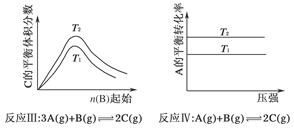
根据以上规律判断,下列结论正确的是( )
| A.反应Ⅰ:ΔH>0,p2>p1 |
| B.反应Ⅱ:ΔH<0,T1>T2 |
| C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 |
| D.反应Ⅳ:ΔH<0,T2>T1 |
对于可逆反应N2(g)+3H2(g) 2NH3(g);ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g);ΔH<0,下列研究目的和示意图相符的是( )
| A |
B |
C |
D |
|
| 研究 目的 |
压强对反应的影响(p2>p1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
| 示 意 图 |
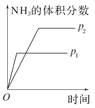 |
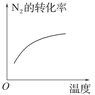 |
 |
 |
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2Z(g);ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
| 选项 |
改变条件 |
新平衡与原平衡比较 |
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |