下列化学性质中,烷烃不具备的是( )
| A.一定条件下发生分解反应 | B.可以在空气中燃烧 |
| C.与Cl2发生取代反应 | D.能使高锰酸钾溶液褪色 |
下列说法正确的是( )
| A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色 |
| B.欲除去Cl2中的少量HCl气体,可将此混合气体通入盛有饱和食盐水的洗气瓶 |
| C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
| D.实验室用MnO2和稀HCl加热法制取Cl2,若有14.6 gHCl参加反应,则可制得7.1 g Cl2 |
将2.3 g金属钠投入100 g水中,反应结束后,溶液中溶质的质量分数计算式表示正确的是( )
A.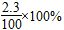 |
B.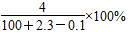 |
C. |
D.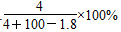 |
在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是
| A.3:2 | B.2:1 | C.1:1 | D.2:3 |
下列各组微粒,在溶液中能大量共存的是
| A.K+、H+、NO3—、Cl— | B.Cu2+、Cl—、OH¯、SO42— |
| C.H+、Na+、CO32—、Cl— | D.Ca2+、Cl—、K+、CO32— |
不能使湿润的碘化钾淀粉试纸变蓝的是()
| A.氯水 | B.碘水 | C.溴水 | D.氯化钾溶液 |