在120 ℃,101 kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧后消耗相同条件下氧气的体积也为a mL(即x="a" mL),则原混合气体中CH4的体积分数是_________。
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是_________。现要测定原混合气体中H2的体积分数,还必须知道相同条件下的其他数据,它们可以是_________ (填选项字母)。
A.2a mol混合气体的密度
B.生成CO2气体的总体积
C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧所得气体中只有CO2和H2O(g),则x的取值范围是_________。
(7分)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题: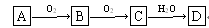
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①D的化学式是________;
②在工业生产中B气体的大量排放被雨水吸收后形成了________而污染了环境.
(2)若A在常温下为气体,C是红棕色的气体.
①A、C的化学式分别是:A________;C________.
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式____________________________________________________________________________________________.该反应________(填“属于”或“不属于”)氧化还原反应.
(6分)A、B两种气体组成的混合气体(相对分子质量A大于B),只含氮氢两种元素.不论A、B以何种比例混合,混合气体中氮氢两种元素的质量比始终大于14∶3,则A为________,B为________(填化学式).若混合气体中氮氢两元素的质量之比为14∶1,则混合物中A、B的物质的量之比为________.
(16分)直接生成碳-碳键的反应是实现高效、绿色有机合成的重要途径。交叉脱氢偶联反应是近年倍受关注的一类直接生成碳-碳单键的新型反应,例如:
化合物Ⅰ可由以下合成路线获得:
Ⅱ(分子式为C3H8O2)氧化→
(1)化合物Ⅰ的分子式为;
其完全水解的化学方程式为(注明条件)。
(2)化合物II与氢溴酸反应的化学方程式为(注明条件)。
(3)化合物Ⅲ没有酸性,其结构简式为;Ⅲ的一种同分异构体Ⅴ能与饱和 NaHCO3溶液反应放出CO2,化合物Ⅴ的结构简式为。
(4)反应①中1个脱氢剂Ⅵ(结构简式如图)分子获得2个氢原子后,转变成1个芳香族化合物分子。该芳香族化合物分子的结构简式为________。
(5)1 分子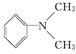 与 1 分子
与 1 分子 在一定条件下可发生类似反应①的反应,其产物分子的结构简式为________;1 mol 该产物最多可与________mol H2发生加成反应。
在一定条件下可发生类似反应①的反应,其产物分子的结构简式为________;1 mol 该产物最多可与________mol H2发生加成反应。
(12分)中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,C在常温下为无色的液体,D是红棕色气体。(图中部分产物和反应条件已略去)
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式_________________________________。
(2)C的电子式是___________________________。
(3)除去G固体中含有H杂质采用的方法是_____________________。
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)_____________________________。
(5)写出由F转化为E的离子方程式____________________________________;
(6)写出由G转化为H的离子方程式____________________________________。
(12分)欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 n/mol T/℃ |
活性炭 |
NO |
E |
F |
| 初始 |
2.030 |
0.100 |
0 |
0 |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①请结合上表数据,写出NO与活性炭反应的化学方程式。
②根据上述信息判断,温度T1和T2的关系是(填序号)。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质, CO 为阳极燃气,空气与 CO2的混和气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO + 2CO32- =4CO2 +4e-则阴极反应式:,电池总反应式:。