某有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量比为1∶1,由此可得出的结论是( )
A.该有机物分子中C、H、O个数比为1∶2∶3
B.分子中碳、氢原子个数比为2∶1
C.有机物中必定含氧
D.无法判断有机物中是否含有氧元素
鸦片具有复杂的组成,其中的罂粟碱的分子结构如下: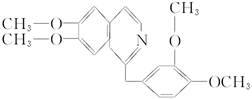
鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短。已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是()
| A.23.25 mol;5 |
| B.24.5 mol;7 |
| C.24.5 mol;8 |
| D.26.5 mol;6 |
下列药物类型中由于过度使用导致人类面临无药可用的危机的是()
| A.中成药 | B.抗生素 | C.抗酸药 | D.解热镇痛药 |
2003年春,广东、北京等地发生了非典型肺炎,其原因是由病毒感染引起的。不少群众购买醋精用于室内消毒灭菌,这是因为醋精()
| A.沸点低 |
| B.能使蛋白质变性 |
| C.有酸性 |
| D.具有医疗保健作用 |
可以判断油脂皂化反应基本完成的现象是()
| A.反应液可使红色石蕊试纸变蓝 |
| B.反应液可使蓝色石蕊试纸变红 |
| C.反应后静置,反应液分为两层 |
| D.反应后静置,反应液不分层 |
为防止水体污染,我国许多地区对洗衣粉的成分加以限制,这些地区销售的洗衣粉不得含有()
| A.硅酸钠 | B.烷基苯磺酸钠 | C.三聚磷酸钠 | D.蛋白酶 |