根据下列框图回答问题(答题时,方程式中的、用所对应的元素符号表示):

(1)写出溶于稀和混合液的化学方程式:
(2)某同学取的溶液,酸化后加入、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:、。
(3)写出将氧化为的化学方程式:。
(4)由制备的的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
二氯化硫(Cl—S—S—Cl,直线形)是一种琥珀色液体,是合成硫化染料的重要原料。
(1)写出它的电子式。
(2)指出它分子内的键型。
(3)估计它能不能易溶于水______________。
(4)指出硫元素的化合价为______________。
按要求完成下列问题。
(1)写出Mg2+的电子排布式。
(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、________、________。
(4)下列分子中若有手性分子,请用“*”标出其手性碳原子。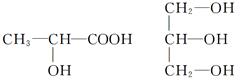
测定石灰石中钙元素的质量百分含量时,都是先把钙元素全部转化为草酸钙沉淀 (CaC2O4・H2O),然后将草酸钙沉淀 (CaC2O4・H2O),用硫酸溶解,用a mol/L的标准高锰酸钾溶液滴定生成的草酸,发生化学反应:H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)。
(1)配平后离子方程式的系数依次为、、、、、。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、250mL容量瓶外,还需。
(3)上述实验中的KMnO4溶液需要酸化,不能使用盐酸酸化的原因是。
(4)开始取用样品的质量为m g,硫酸溶解后所得草酸溶液的体积为100mL,每次取25.00mL进行滴定,达到滴定终点时所耗KMnO4溶液体积为 b mL,所得草酸溶液的物质的量的浓度是;石灰石中钙元素的质量百分含量为。(相对原子质量:Ca—40)
依据叙述,写出下列反应的热化学方程式。
(1)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出450 kJ的热量。其热化学方程式为______________________。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、395 kJ、940 kJ,则N2与H2反应生成NH3的热化学方程式为____________________________。
(3)钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为:
已知:①C(s)+O2(g)  CO2(g);ΔH=-395.5 kJ·mol-1
CO2(g);ΔH=-395.5 kJ·mol-1
②2CO(g)+O2(g)  2CO2(g);ΔH=-560 kJ·mol-1
2CO2(g);ΔH=-560 kJ·mol-1
③TiO2(s)+2Cl2(g)+2C(s)  TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
则TiO2(s)与Cl2(g)反应的热化学方程式为。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1) 元素名称: B ______ ; D ______。
(2) C元素位于周期表中周期族。
(3) 写出A的最高价氧化物与过量的C的最高价氧化物的水化物反应的离子方程式:
__________________________________________________________________________。
(4) 用电子式表示化合物 C2D 的形成过程:
__________________________________________________________________________。