A.已知、、、、都是周期表中前四周期的元素,它们的核电荷数<<<<。其中、、是同一周期的非金属元素。化合物的晶体为离子晶体,的二价阳离子与的阴离子具有相同的电子层结构。为非极性分子。、的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,能与、的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,、、、、用所对应的元素符号表示)
(1)、、的第一电离能由小到大的顺序为
(2)的氢化物的分子空间构型是
(3)写出化合物的电子式
(4)的核外电子排布式是
(5)的最高价氧化物对应的水化物的稀溶液与D的单质反应时,被还原到最低价,该反应的化学方程式是
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
+ +①
+①
+ + ②
+ ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,-被浓硫酸氧化为等。有关数据列表如下;
| 乙醇 |
溴乙烷 |
正丁醇 |
1-溴丁烷 |
|
| 密度/-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
| 沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在
(4)制备操作中,加入的浓硫酸必需进行稀释,起目的是
a.减少副产物烯和醚的生成 b.减少的生成
c.减少的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质,下列物质中最适合的是
a.b.c.d.
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于
在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是,一定互为同分异构体的是。(填编号)
苯甲酸重结晶的实验操作步骤:加热溶解、、、 过滤洗涤、烘干装瓶,在第一次过滤的过程前加入少量的水的目的:
(1)写出下列微粒的电子式:
-CH3(2)-OH (3)C2H2(4)OH–
(2)1molBr 和1molBr2完全加成,试写出产物可能有的结构简式:。
和1molBr2完全加成,试写出产物可能有的结构简式:。
( 6分)在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示。请认真观察右图,然后回答问题。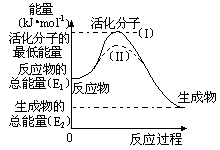
(1)图中反应是(填“吸热”或“放热”)反应,该反应(填“需要”或“不需要”)环境先提供能量,该反应的ΔH=(用含E1、E2的代数式表示)。
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能(填“增大”或“减小” 或“不变”),活化分子的百分数(填“增大”或“减小” 或“不变”),因此反应速率,(填“增大”或“减小” 或“不变”)。
简答题( 9分)(1)已知:C2H6O(g) + 3O2(g) ="=" 2CO2(g) + 3H2O(g)△H1
H2O(g)==H2O(l)△H2 ;
C2H6O(g)==C2H6O(l)△H3
若使1mol C2H6O(l)完全燃烧生成液态水,则放出的热量为(用符号表示)
(2)对于可逆反应CO(g)+H2O (g)  CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
①恒温恒压时,向容器中充入0.5mol的He,这时反应速率(填“加快”、“减慢”或 “不变”),原因是
②恒温恒容时,加入0.3mol的CO,这时反应速率(填“加快”、“减慢”或 “不变”),原因是。