下列离子方程式书写正确的是 ( )
| A.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO |
B.NH4HSO3溶液与足量的NaOH溶液混合后加热:NH4+ +HSO3- +2OH-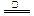 NH3↑+SO32-+2H2O NH3↑+SO32-+2H2O |
| C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3- +5I-+3H2O=3I2+6OH- |
| D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42- = CaSO4↓+H2O |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是()
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量少 |
| C.甲的摩尔体积比乙的摩尔体积小 |
| D.甲的相对分子质量比乙的相对分子质量小 |
在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应:
2R(g)+5Q(g)====4X(g)+nY(g)
反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是()
| A.2 | B.3 | C.4 | D.5 |
将一块铁片放入500 mL 1 mol·L-1的CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8 g,反应后溶液中CuSO4的物质的量浓度是()
| A.0.9 mol·L-1 | B.0.85 mol·L-1 | C.0.8 mol·L-1 | D.0.75 mol·L-1 |
对于1 mol·L-1的盐酸,下列叙述正确的是(忽略溶液混合时的体积变化)()
| A.标准状况下22.4 L HCl溶于1 L水中配成溶液,即可得到1 mol·L-1的盐酸 |
| B.1 mol·L-1的盐酸的质量分数小于3.65% |
| C.将1 mol·L-1的盐酸与水等质量混合后,所得盐酸的物质的量浓度大于0.51 mol·L-1 |
| D.将1 mol·L-1的盐酸与5 mol·L-1的盐酸等质量混合后,所得盐酸的物质的量浓度为3 mol·L-1 |
分取100 mL 18.3 mol·L-1的H2SO4与Zn反应,当Zn完全溶解时,生成的气体(可使品红褪色)在标准状况下的体积为22.4 L。将所得的溶液稀释成1 L,测得溶液H+的浓度为1 mol·L-1,则所生成的气体中SO2与H2的体积比约为()
| A.1∶2 | B.2∶1 | C.1∶4 | D.4∶1 |