CH3—CH3→CH2=CH2+H2;有关化学键的键能如下。
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ·mol—1) |
414.4 |
615.3 |
347.4 |
435.3 |
试计算该反应的反应热
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.1 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。(已知:一个碳上接两个羟基是不稳定的)
将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2 H2(g) + CO(g) 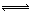 CH3OH(g),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,
CH3OH(g),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,
求:(1)H2的反应速率;(2)CO的转化率。
在25℃时,向100mL含氯化氢14.6g的盐酸里,放入5.6g铁粉(不考虑反应前后溶液体积的
变化),反应开始到2min末收集到H2 1.12L(标准状况),在此后,又经过4min,铁粉完全溶解。则:
(1)在前2min内用FeCl2 表示的平均反应速率是多少?
(2)在后4min内用HCl表示的 平均反应速率是多少?
(3)前2min与后4min相比,反应速率哪个较快?为什么?
在一密闭的2L容器中装有4molSO2和2molO2,在一定条件下开始反应。2min末测得容器中有1.6molSO2,请计算:
(1)2min末SO3的浓度;
(2)2min内SO2的平均反应速率。
一定质量的甲烷和CO的混合气体完全燃烧后得到CO2、水蒸气,总质量为204g,当其缓慢经过无水CaCl2充分吸收水分后,CaCl2增重72g。求原混合气体中甲烷和CO的物质的量。