设NA为阿伏加德罗常数。下列叙述中正确的是 ( )
| A.通常状况下,32 g O2与32 g O3所含的氧原子数均为2NA |
| B.1 mol铁丝在1 mol Cl2中充分燃烧时转移的电子数为3NA |
| C.向某密闭容器中通入2 mol SO2和1 mol O2,在高温和催化条件下充分反应后容器内分子总数为2NA |
| D.等体积等物质的量浓度的K2CO3溶液与K2SO4溶液中离子总数相等 |
分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的有机物有(不考虑立体异构)
| A.3种 | B.5种 | C.6种 | D.7 种 |
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是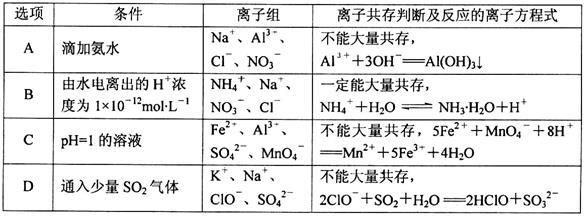
下列离子方程式书写正确的是
A.向苯酚钠溶液中通入少量CO2: 2C6H5O +CO2+H2O→2C6H5OH+CO32- +CO2+H2O→2C6H5OH+CO32- |
B.NH4HSO3溶液与足量NaOH溶液反应:HSO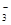 +OH-=SO32-+H2O +OH-=SO32-+H2O |
| C.Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O |
D.H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO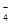 +6H+= +6H+= |
根据原子结构及元素周期律的知识,下列叙述正确的是
| A.由于相对分子质量:HCl>HF,故沸点:HCl>HF |
| B.硅处于金属与非金属的过渡位置,硅可用作半导体材料 |
| C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 |
| D.Cl-、S2-、Ca2+、K+半径逐渐减小 |
恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
| 反应时间/min |
n(MgSO4)/mol |
n(CO)/mol |
n(CO2)/ mol |
| 0 |
2.00 |
2.00 |
0 |
| 2 |
0.80 |
||
| 4 |
1.20 |
下列说法正确的是
A.反应在0~2min内的平均速率为v(SO2)=0.6 mol·L-1·min-1
B.反应在2~4min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol