关于苯分子结构的研究经历了很长时间,著名科学家凯库勒最先提出了凯库勒结构式,并较好地解释了苯的一些性质。但随着理论研究的不断深入,杂化轨道理论可以更好地来解释苯分子的结构和性质。以下有关苯分子结构的说法,错误的是( )
| A.苯分子中每个碳原子的原子轨道都发生sp2杂化,形成夹角为120°的三个sp2杂化轨道 |
| B.每个碳原子的一个sp2杂化轨道采用“肩并肩”的方式重叠,形成一个大Π键 |
| C.苯分子中存在6个C—C σ键和6个C—H σ键 |
| D.乙烷、乙烯、乙炔分子中,碳原子轨道杂化方式和苯相同的只有乙烯 |
原计划实现全球卫星通讯需发射77颗卫星,这一数字与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”.已知铱的一种同位素的质量数为191,则其核内的中子数与质子数之差是
| A.77 | B.114 | C.37 | D.268 |
某化学学习小组学习电化学后,设计了下面的实验装置图:
下列有关该装置图的说法中正确的是( )
| A.合上电键后,盐桥中的阳离子向甲池移动 |
| B.合上电键后,丙池为电镀银的电镀池 |
| C.合上电键后一段时间,丙池中溶液的pH增大 |
| D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )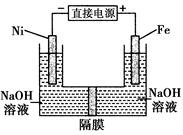
| A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO+8H+ |
| B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH- |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
下图所示的实验方法、装置或操作完全正确的是 ()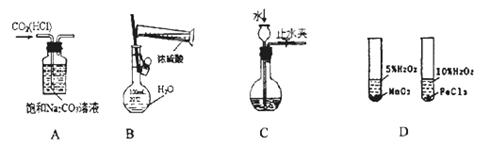
| A.除去CO2中的HCl | B.稀释浓H2SO4 |
| C.检查装置气密性 | D.研究不同催化剂对反应速率的影响 |
甲、乙两种金属性质比较:①甲的单质熔、沸点比乙的低;②常温下,甲能与水反应放出氢气而乙不能;③最高价氧化物对应的水化物碱性比较,乙比甲的强;④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡。上述项目中能够说明甲比乙的金属性强的是( )
| A.①② | B.②④ | C.②③ | D.①③ |