在一定温度和压强下,有如下反应:
2SO2(g)+O2(g)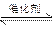 2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。请回答下列问题。
2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。请回答下列问题。
(1)达平衡时混合气体的体积为___________,SO2的转化率为___________;
(2)若起始时加入a mol SO2、b mol O2,且a∶b=2∶1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120 L。则a、b的值分别为:a=___________,b=___________。
(3)若容器为体积不变的密闭容器,其容积为100 L。起始时加入x mol SO2、y mol O2和z molSO3,反应达到平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同。则x、y应该满足的关系式为___________,x、z应该满足的关系式为___________。
某烷烃和烯烃混合气2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,使硫酸质量增加4.05g;再通过碱石灰,使碱石灰质量增加6.60g,另取等量混合气,通入过量溴水中,溴水质量增加1.05g。
(1)通过计算和分析判断混合气由哪两种烃组成?
(2)计算两烃的物质的量之比。
标准状况下1.68 L无色可燃性气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气态烃,通过计算推断它的分子式。
0.2mol 有机物和 0.4mol O2在密闭容器中燃烧后的产物为 CO2、CO 和 H2O(g)。 燃烧后的这些产物经过浓H2SO4后,质量增加 10.8g;再通过灼热的 CuO 充分反 应后,固体质量减轻 3.2g,最后气体再通过碱石灰被完全吸收,质量增加 17.6g。
(1)推断该有机物的分子式。
(2)若 0.2mol 该有机物在与过量的金属钠完全反应后放出 4.48LH2(标准状 况),试确 定有机物的结构简式。