在

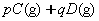 反应中,达到平衡后,的质量分数D%随温度、压强的变化曲线如下图所示正确的结论是( )。
反应中,达到平衡后,的质量分数D%随温度、压强的变化曲线如下图所示正确的结论是( )。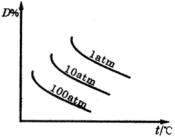
A.正反应放热,且 |
B.正反应放热,且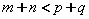 |
C.正反应吸热,且 |
D.正反应吸热,且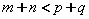 |
已知700K时,N2+3H2 2NH3ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是
2NH3ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是
| A.Q = Q1 = 1/2Q2 | B.Q>Q1>2Q2 |
| C.Q>2Q2>Q1 | D.Q = Q1 = Q2 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH<0
2 PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是

将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
| A.2v(NH3)= v(CO2) |
| B.密闭容器中气体的总物质的量不变 |
| C.密闭容器中混合气体的密度不变 |
| D.密闭容器中二氧化碳的体积分数不变 |
一定量的混合气体,在密闭容器中发生如下反应:xA(g) + yB(g)  zC(g),达到平衡后测得A气体的浓度为2.5mol/L,当恒温下将密闭容器的容积缩小到原体积1/2时,再达到平衡后,测得A浓度为4.5mol/L,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为2.5mol/L,当恒温下将密闭容器的容积缩小到原体积1/2时,再达到平衡后,测得A浓度为4.5mol/L,则下列叙述正确的是
| A.平衡向逆反应方向移动 |
| B.x + y < z |
| C.C的体积分数提高 |
| D.B的转化率提高 |
密闭容器中,反应2A+B  2C达平衡时,若增大压强,则平衡向生成C的方向移动,则以下关于此反应的叙述中正确的是
2C达平衡时,若增大压强,则平衡向生成C的方向移动,则以下关于此反应的叙述中正确的是
A.A和B中至少有一种是气体
B. C肯定不是气体
C.如果C为气体,A、B一定均为气体
D. A、B、C一定均为气体