“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如右图装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是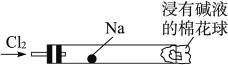
| A.反应生成的大量白烟是氯化钠晶体 |
| B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 |
| C.钠着火燃烧产生苍白色火焰 |
| D.若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收 |
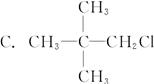
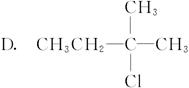
某卤代烷烃C5H11Cl发生消去反应时,可以得到两种烯烃,则该卤代烷烃的结构简式可能为( )
A.CH3CH2CH2CH2CH2Cl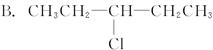
二溴苯有三种同分异构体,其中一种为M,M苯环上的氢原子被一个溴原子取代后,只能得到一种产物。则由M形成的三溴苯只能是( )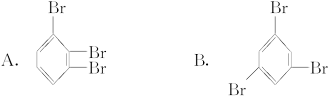
化合物中 上的—OH被卤原子取代所得化合物称为酰卤,下列化合物中可以看作酰氯的是( )
上的—OH被卤原子取代所得化合物称为酰卤,下列化合物中可以看作酰氯的是( )
| A.HCOF | B.CCl4 | C.CH3CH2Br | D.CH2ClCOOH |
下列反应的产物中,有的有同分异构体,有的没有同分异构体。其中一定不存在同分异构体的反应是( )
A.异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
B.2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 |
| C.甲苯在一定条件下发生硝化生成一硝基甲苯 |
| D.溴苯在NaOH水溶液中发生水解反应 |
为了使氯乙烷的水解反应进行得比较完全,水解时需加入( )
| A.NaCl | B.NaHSO4 | C.HCl | D.NaOH |