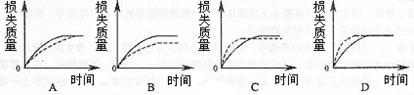
下列有关实验操作的叙述正确的是
A.实验室常用下图所示的装置制取少量的乙酸乙酯 |
| B.用50 mL酸式滴定管可准确量取25.00 mL KMnO4溶液 |
| C.用量筒量取5.00 mL 1.00 mol·L-1盐酸于50 mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸 |
| D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
比较氯元素和硫元素的非金属性的相对强弱,下列方案中不能达到目的的是
| A.加热条件下,氯气和硫分别与铜反应,比较生成物中铜的化合价 |
| B.比较氯化氢和硫化氢的热稳定性 |
| C.往H2S溶液中通入氯气 |
| D.分别测定0.1mol/L氯化钠溶液和0.1mol/L硫化钠溶液的pH |
在一密闭容器中进行2SO2+O2 2SO3的反应,己知反应过程中某一时刻的数据是: SO2、O2、SO3的浓度分别是0.2mol/L、0.1mol/L、 0.2mol/L,当达平衡时可能数据是
2SO3的反应,己知反应过程中某一时刻的数据是: SO2、O2、SO3的浓度分别是0.2mol/L、0.1mol/L、 0.2mol/L,当达平衡时可能数据是
| A.SO20.25mol/L | B.SO2、SO3均为0.15mol/L | C.SO20.4mol/L | D.SO30.4mol/L |
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率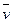 (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.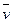 (NH3)=0.010mol•L―1•s―1 (NH3)=0.010mol•L―1•s―1 |
B.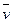 (O2)="0.0010" mol•L―1•s―1 (O2)="0.0010" mol•L―1•s―1 |
C.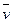 (NO)="0.0010" mol•L―1•s―1 (NO)="0.0010" mol•L―1•s―1 |
D.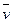 (H2O)="0.045" mol•L―1•s―1 (H2O)="0.045" mol•L―1•s―1 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.参加反应的各物质的性质 | C.反应物的浓度 | D.使用催化剂 |
将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A=B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是