研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
| A.铜与浓硫酸反应后所得的白色固体是CuSO4 |
| B.加BaCl2溶液后生成的白色沉淀是BaSO3 |
| C.白色固体中夹杂的少量黑色物质可能是CuO |
| D.白色固体中夹杂的少量黑色物质中含元素Cu、S,一定是CuS |
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,可以由反应Al2O3+C+N2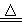 2AlON+CO合成,下列有关说法正确的是
2AlON+CO合成,下列有关说法正确的是
| A.氮氧化铝中氮的化合价是-3 |
| B.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| C.反应中每生成5.7g AlON 同时生成1.12 L CO |
| D.反应中氧化产物和还原产物的物质的量之比是2:1 |
设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.1mol·L-1NaCl溶液含有NA个Na+ |
| B.1.0 L 浓度为18mol·L-1H2SO4溶液与足量的铜片加热条件下反应,被还原的H2SO4的分子数为9NA |
| C.在酸性条件下,1molFe2+ 与足量的H2O2溶液反应,转移2 NA个电子 |
| D.1 mol Na 与足量O2在一定条件下反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
下列叙述错误的是
| A |
B |
C |
D |
 |
 |
  |
 |
| 闪电时会发生反应: N2 + O2  2NO 2NO |
利用丁达尔效应证明烧杯中的分散系是胶体 |
蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 |
加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
下列表述正确的是
A.NaH中氢离子结构示意图为: |
B.NH4I的电子式: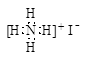 |
C.质子数是82,中子数是122的铅原子: Pb Pb |
D.CO2的比例模型: |
化学在生产和日常生活中有着重要的应用。下列说法正确是
| A.高纯度的硅单质广泛用于制作光导纤维 |
| B.向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO3,可减少对大气的污染 |
| C.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
| D.大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨 |