Ⅰ.下列实验操作或对实验事实的叙述正确的是__________(填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“嘶嘶”的响声;
③配制100 mL 1.00 mol·L-1的NaCl溶液时,可用托盘天平称取5.85 g NaCl固体;
④向可能含有 ,
,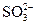 的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验
的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验 的存在;
的存在;
⑤蒸发NaCl溶液,当得到较多NaCl固体时,就停止加热,利用余热蒸干;
⑥向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶液的现象相同。
Ⅱ.(1)若实验需用6 mol·L-1的盐酸250 mL,配制时除需用量筒、烧杯、玻璃棒外,还需用的仪器有:__________、__________。
(2)实验室利用向氨化后的饱和NaCl溶液中通入过量的CO2来制备NaHCO3晶体,为了分离出NaHCO3晶体,必须用到右图中__________(填序号)装置。
(3)写出生成NaHCO3的化学方程式:______________________________。
下列化学用语的理解正确的是()
化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是()
| A.大量使用化肥和农药,以提高农作物产量 |
| B.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
| C.“天宫一号”中使用的碳纤维,是一种新型有机高分子材料 |
| D.为改善食品的色、香、味并防止变质,可加入大量食品添加剂 |
某无色溶液中可能含有Na+、K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
① pH试纸检验,溶液的pH > 7。
② 取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③ 另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。
④ 向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。
⑤ 在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。
则关于原溶液的判断中不正确的是()
| A.肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤 ④ 改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。 |
向2mL 、0.5mol/L的FeCl3溶液中加入3mL 、3mol/L KF溶液,结果FeCl3溶液褪成无色,向褪色后的溶液中继续加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是()
| A.Fe3+ 不与I-发生反应 |
| B.Fe3+ 与F- 结合成不与I- 反应的物质 |
| C.F- 使I- 的还原性减弱,因而不反应 |
| D.Fe3+ 被F- 还原为Fe2+,使溶液中不再存在Fe3+ |
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(每次加入的盐酸的物质的量浓度相等),下列分析不正确的是()
| 盐酸 /mL |
50 |
50 |
50 |
| m(混合物)/g |
9.2 |
15.7 |
27.6 |
| V(CO2)(标况)/L |
2.24 |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据能计算混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应