某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设:__________________________________________________。
步骤二:查阅资料。得出:①+1价的铜在酸性条件下易发生自身氧化还原反应;②在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
| A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化 |
| B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣 |
| C.取该红色沉淀a g,在空气中充分灼烧至完全变黑,放在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为b g,比较a,b的关系 |
| D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出 |
你认为合理的方案是(填字母)__________。
(2)乙小组对甲小组的假设,另设计如下图所示装置进行验证。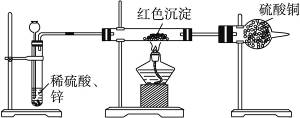
若按乙组装置定性检验上述红色沉淀部分,可根据__________现象的发生与否即可判断。
若按乙组装置测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量__________(填序号)。
①通入氢气的体积 ②反应前红色沉淀和硬质玻璃管的总质量
③完全反应后红色固体和硬质玻璃管的总质量 ④实验前干燥管质量
⑤硬质玻璃管质量 ⑥锌粒质量
⑦稀硫酸中含溶质的量 ⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有____________________(请写出两点)。
下图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应的曲线变化关系的实验项( )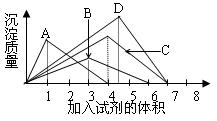
| A.硝酸银溶液中加入氨水溶液 |
| B.往澄清石灰水中逐渐通入CO2气体 |
| C.往AlCl3溶液中逐NaOH溶液 |
| D.往NaAlO2溶液中逐滴加入盐酸溶液 |
下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤等物质的量的两单质分别与氯气反应时生成阳离子时,甲失去的电子数比乙多
| A.全部可以 | B.仅②不可以 | C.仅②⑤不可以 | D.③④可以 |
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的( )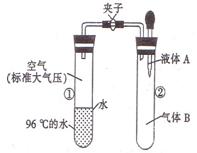
| A.氢氧化钠溶液、二氧化碳 | B.水、氨气 |
| C.氢氧化钠溶液、一氧化氮 | D.水、二氧化氮 |
下列离子方程式正确的是( )
A.在硫酸氢钾溶液中加入Ba(OH)2溶液使SO42-恰好完全沉淀:
2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O
B.在银氨溶液中滴加过量氢溴酸:
[Ag(NH3)2]++OH-+3H++Br-=AgBr↓+2NH4++H2O
C.向NaHS溶液中滴加少量CuCl2溶液:S2-+Cu2+=CuS↓
下列有关实验操作的叙述正确的是( )
| A.实验室常用上图所示的装置制取少量的乙酸乙酯。 |
| B.用50mL酸式滴定管可准确量取 25.00mLKMnO4溶液 |
| C.用量筒量取5.00 mL1.00mol·L-1盐酸于50mL 容量瓶 中,加水稀释至刻度,可配制0.100mol·L-1盐酸。 |
| D.用苯萃取溴水中的溴,分液时有机层从分液漏斗 |
的下端放出