反应4NH3(g)+5O2(g)====4NO(g)+6H2O(g)在2 L密闭容器中进行1分钟后,NH3减少了0.12 mol,则平均每秒钟浓度变化正确的是
| A.NO:0.001 mol·L-1 | B.H2O:0.002 mol·L-1 |
| C.NH3:0.002 mol·L-1 | D.O2:0.0025 mol·L-1 |
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱。由此判断下列说法正确的是
| A.金属镁的熔点高于金属铝 |
| B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的 |
| C.金属镁的硬度小于金属钙 |
| D.金属铝的硬度大于金属钠 |
下列有关实验装置进行的相应实验,能达到实验目的的是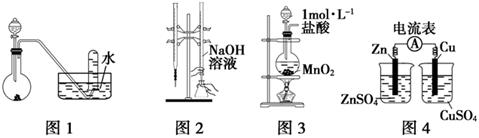
| A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO |
| B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置检验电流的方向 |
短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y与Z的原子最外层电子数之比为2:1.下列说法不正确的是
| A.X与Y只能形成两种化台物 |
| B.简单离子的半径大小:Y<X |
| C.X、Y、Z三种元素形成的化合物中既存在共价键又存在离子键 |
| D.Z形成的简单离子是其所在周期元素形成的简单离子中半径最小的 |
把下列4种Na2S2O3溶液和相应体积的水,分别加入4个盛有20 mL 2 mol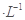 硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
 其中最早出现明显浑浊的是
其中最早出现明显浑浊的是
A.25  .20 mL 3 mol .20 mL 3 mol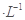 的Na2S2O3溶液,25 mL蒸馏水 的Na2S2O3溶液,25 mL蒸馏水 |
B.0  .30 mL 2 mol .30 mL 2 mol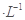 的Na2S2O3溶液,15 mL蒸馏水 的Na2S2O3溶液,15 mL蒸馏水 |
C.25  .10 mL 4 mol .10 mL 4 mol 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
D.0  .10 mL 2mol .10 mL 2mol 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
已知反应: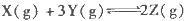 为放热反应,一定温度下在密闭容器中进行反应,
为放热反应,一定温度下在密闭容器中进行反应,
下图是该反应达平衡及改变条件平衡移动的图像。下列说法正确的是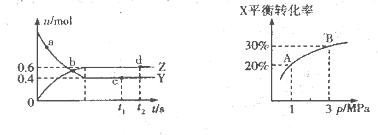
A.图中的a、b、c、d都是平衡点
B.起始时,加入Y的物质的量为1.3 mol,
C.c点和d点表示正反应速率大于逆反应速率
D.在3 MPa和1 MPa条件下,反应达平衡时,放出的热量:Q(A)>Q(B)