“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备: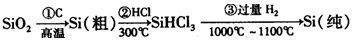
①写出步骤①的化学方程式 。
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点—84.7℃),提纯SiHCl3的主要化学操作的名称是 ;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式 。
③请写出二氧化硅与氢氟酸反应的化学方程式 。
(2)磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反应式 。
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:
, 。
(4)纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是 ,三氯化铁溶液可以加速伤口止血,请简述原因 。
(5)高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂
[AlFe(OH)nCl6—n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为 。
一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2=CH—CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式 。
向10 0mLBa(OH)2溶液中加
0mLBa(OH)2溶液中加 入过量的NaHCO3溶液生成BaCO3沉淀,过滤,将沉淀置于过量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应并收集到1.12L(标准状况下)气体。
入过量的NaHCO3溶液生成BaCO3沉淀,过滤,将沉淀置于过量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应并收集到1.12L(标准状况下)气体。
(1)Ba(OH)2与过量的NaHCO3溶液反应的化学方程式。
(2)生成BaCO3沉淀的质量__________g。
(3)100mL Ba(OH)2溶液中溶质Ba(OH)2的物质的量浓度__________mol/L。
(4)最初加入的NaHCO3溶液中含NaHCO3的物质的量__________mol。
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的500mL稀H2SO4溶液的操作,请按要求填空:
(1)所需浓H2SO4的体积为mL。
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配 溶液浓度将(偏高、偏低、无影响)。
溶液浓度将(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL蒸馏水的里,并不断搅拌。
(4)将冷却至室温的上述溶液沿注入中,并用蒸馏水洗涤烧杯2~3次,洗涤液也要注入其中,并摇匀。
(5)加水至距刻度线下cm时,改用加水,使溶液的凹液面正好跟刻度相切。
下列三组物质中,均有一种物质的类别与其它三种不同
A.MgO、Na2O、CO2、CuO
B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):A;BC。
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应(“是”或“不是”)氧化还原反应。
(3)写出物质C与足量稀硫酸溶液反应的离子方程式:。
某溶液有Cl-、CO32-、SO42-等,今要求在一次样液中先后检验出这三种离子,请完成下列实验设计:先加足量__________溶液,生成气泡,确定CO32-存在;再加足量__________溶液,现象是_________,确定SO42-存在;过滤后加__________溶液,现象是生成白色沉淀,确定Cl-存在。
在反应5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,氧化剂是__________,还原剂是__________;氧化剂具有__________性;被氧化和被还原的原子数之比是__________。