右图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是:
| 选项 |
电源X极 |
实验前U形 管中液体 |
通电后现象及结论 |
| A |
正极 |
Na2SO4溶液 |
U形管两端滴入酚酞后,a管中呈红色 |
| B |
正极 |
AgNO3溶液 |
b管中电极反应式是 4OH— -4e-=2H2O+O2↑ |
| C |
负极 |
KCl和CuCl2混合溶液 |
相同条件下,a、b两管中产生的气体总体积可能相等 |
| D |
负极 |
Fe(OH)3胶体和导电液 |
b管中液体颜色加深 |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是()
| A.Z的最高价氧化物在常温的条件下能与W的氢化物的水溶液反应 |
| B.原子半径由小到大的顺序:X< Y < Z< W |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温条件下不可以用Y制的容器盛放浓硫酸 |
设NA为阿伏加德罗常数,下列叙述中正确的是()
| A.0.3mol NO2气体溶于足量水中充分反应转移的电子总数为0.2 NA |
| B.7.8g Na2O2固体中含有的离子总数为0.4NA |
| C.标准状况下,22.4L SO3与足量水充分反应生成的H+的总数为2NA |
| D.0.5mol Fe与过量的硫在加热的条件下充分反应得到的电子总数为1.5NA |
下列离子方程式中书写正确的是( )
| A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2++OH-+H++SO42-= BaSO4↓+H2O |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-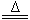 NH3↑+H2O NH3↑+H2O |
| C.稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=" 3" Fe3++2 NO↑+4 H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+="2" H2O+I2 |
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是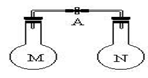
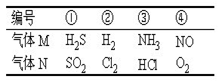
| A.①②③④ | B.②④①③ |
| C.④①②③ | D.①④③② |
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是( )
| A.化合物YZ3极易溶解于水 |
| B.Z与M可以形成含18个电子的化合物 |
| C.12g 14X中含有中子的物质的量为8mol |
| D.由上述四种元素组成的某盐可能受热易分解 |