将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/LnaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列叙述中正确的是 ( )
| A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为100mL |
| B.当金属全部溶解时收集到NO气体的体积为2.24L |
| C.参加反应的金属的总质量一定是6.6g |
| D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
下列事故处理方法不正确的是()
| A.碰翻酒精灯失火时,立即用湿布盖灭 |
| B.电线短路失火时,立即用泡沫灭火器灭火 |
| C.浓硫酸溅到皮肤上,立即用大量水冲洗,然后涂上稀碳酸氢钠溶液 |
| D.浓碱溅到眼睛里,立即用大量水冲洗,边洗边眨眼睛 |
实验室加热高锰酸钾制取氧气时,一般有以下的操作过程;
①放置酒精灯;②固定装好试剂的试管;③加热;④用排水法集气;⑤停止加热;⑥将导管移出水面。正确的操作顺序为()
| A.②③④⑥⑤ | B.②③④⑤⑥ |
| C.②①③④⑥⑤ | D.①②③④⑥⑤ |
下列措施中不能加快固体物质溶解的是()
| A.搅拌 | B.适当加热 | C.将块状固体研细 | D.多加水 |
以下是一些常用的危险品标志,装运浓硫酸的贮运罐应贴的图标是()
A B C D
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是()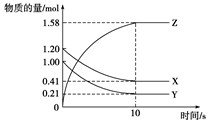
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |