用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.0.1mol/L的NaOH溶液中钠离子数为0.1 NA |
| B.1.8 g重水(D2O)中,含有的质子数为0.1NA |
| C.5.6 g铁投入浓硫酸中,生成的气体分子数为0.1NA |
| D.标准状况下,560 mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1 NA |
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
NH4Cl是强酸弱碱盐 |
将NH4Cl溶液蒸干可制备NH4Cl固体 |
| B |
Fe3+有强氧化性 |
用KSCN溶液可以鉴别Fe3+ |
| C |
SO2有还原性 |
用SO2可使溴水褪色 |
| D |
Cl2有漂白性 |
用Cl2可与石灰乳反应制备含氯消毒剂 |
实验室制Cl2的反应为4HCl(浓)+MnO2高温MnCl2+C12↑+2H2O.下列说法错误的是
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1 molCl2,转移电子的物质的量为2 mol |
| C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol |
| D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
下列推断合理的是
| A.在常温下,Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3;在高温下,Na2CO3+SiO2= Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3; |
| B.胶体区别于其他分散系的本质特点是能产生丁达尔现象 |
| C.KAl(SO4)2·12H2O是复盐;(NH4)2Fe(SO4)2也是复盐 |
| D.CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
某溶液中含有AlO2-、SO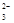 、SO
、SO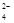 、Na+,向其中加入Na2O2后,溶液中浓度基本保持不变的离子是
、Na+,向其中加入Na2O2后,溶液中浓度基本保持不变的离子是
A.SO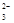 |
B.Na+ | C.AlO2- | D.SO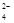 |