[化学——选修化学与技术]
技术的发展与创新永无止境。我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示: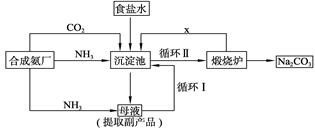
(1)向沉淀池中要通入CO2和氨气,应先通入__________(填化学式),原因是__________。
(2)沉淀池中发生反应的化学方程式是__________。
(3)母液中的溶质主要是__________,向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是__________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环;物质x是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式__________。
(6)这样制得的产品碳酸钠中可能含有的杂质是__________(填化学式),为检验该杂质的存在,具体操作是__________。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为。
(3)验证滤液B含Fe3+,可取少量滤液并加入(填试剂名称)。
(4)滤液E、K中溶质的主要成分是(填化学式),写出该溶质的一种用途:。
(5)已在298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=。
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: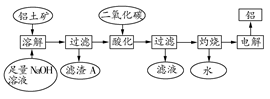
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式:。
(2)滤渣A的主要成分为;滤渣A的用途是(只写一种);实验室过滤时使用玻璃棒,其作用是。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是。
(4)若将铝溶解,下列试剂中最好选用(填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
理由是。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于过量氢氧化钠溶液后,溶液中铝元素的存在形式为(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:。
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
①;②;③;④。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。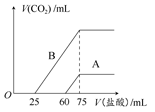
①分别加入足量的盐酸后,溶液中的溶质是,原NaOH溶液的物质的量浓度是。
②A曲线表明,通入CO2后,溶液中的溶质是,与盐酸反应产生CO2的最大体积是mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为,其物质的量之比为。
镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下: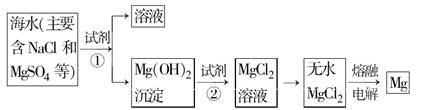
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是。
(3)试剂②可以选用,其反应的离子方程式为。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为L。