有三种质子数均在1—18之间的元素X、Y、Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是( )
A.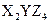 |
B.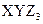 |
C.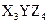 |
D.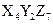 |
同体积同物质的量浓度的几种可溶性盐的溶液中,一定具有相同的
| A.溶质的物质的量 | B.溶质的质量 |
| C.溶质的摩尔质量 | D.离子总数 |
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
| A.体积 | B.分子数 | C.原子数 | D.物质的量 |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入适量的稀盐酸至无气泡产生;⑤过滤
正确的操作顺序是
| A.③②①⑤④ | B.①②③⑤④ |
| C.②③①④⑤ | D.③⑤②①④ |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4LH2O含有的分子数为 NA |
| B.常温常压下,NA个CO2分子占有的体积为22.4L |
| C.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA |
实验中的下列操作正确的是
| A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B.Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道 |
| C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |