某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3 (g) △H<0。下列分析正确的是 ( )
2NH3 (g) △H<0。下列分析正确的是 ( )
| A.平衡后加入N2,该反应的△H增大 |
| B.若平衡昏升高温度,则平衡常数K变大 |
| C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大 |
| D.若反应前充人的N2与H2物质的量相等,达平衡时N2的转化率比H2的高 |
关于浓度均为0.1mol/L的三种溶液:①NH3·H2O、②HCl、③NH4Cl,下列说法正确的是
| A.水电离出的c(H+):②>③ |
| B.①、②和③等体积混合后的溶液:pH=7 |
C.①和②等体积混合后的溶液: c(H+)=c(OH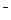 )+ c(NH3·H2O) )+ c(NH3·H2O) |
D.①和③等体积混合后的溶液: c(Cl-)>c(NH4+)>c(OH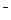 )>c(H+) )>c(H+) |
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)
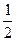 N2(g)+CO2(g)△H=-373.4kJ·mol-1
N2(g)+CO2(g)△H=-373.4kJ·mol-1
在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
某酸溶液中c(H+)=0.1mol·L-1,则该酸溶液的物质的量浓度
| A.一定等于0.1mol·L-1 | B.一定大于0.1mol·L-1 |
| C.一定小于0.1mol·L-1 | D.无法确定 |
氢气是人类最理想的能源。已知在25℃、101kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9kJ,今有如下三个热化学方程式:
(1)H2(g)+ O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1
(2)H2O(l) = H2(g)+ O2(g) ΔH2=b kJ·mol-1
O2(g) ΔH2=b kJ·mol-1
(3)2H2(g)+O2(g) = 2H2O(l) ΔH3=c kJ·mol-1
下列关于它们的表述正确的是
| A.2b=c | B.b=285.8 |
| C.a=-b | D.氢气的燃烧热为a kJ·mol-1 |
某有机化合物A只含碳、氢、氧三种元素,常用作局部麻醉剂和镇痛剂。,其分子模型如右图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列说法错误的是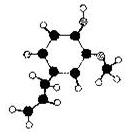
| A.它的分子式为C10H12O2 |
| B.有机物A是苯酚的同系物 |
| C.1molA与足量的浓溴水反应最多可能消耗2 molBr2 |
| D.有机物A遇FeCl3溶液显紫色,至少有12个原子共平面 |