某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,
观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气体积的关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中的一种方法 。
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过下图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。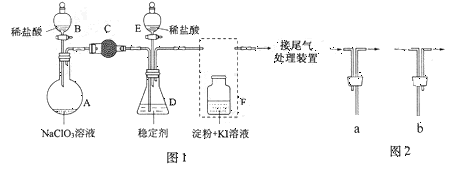
(1)仪器D的名称是 。安装F中导管时,应选用上图2中的 (填a或b)。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2在D中被稳定剂充分吸收,向A中滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 (填稳定剂Ⅰ或稳定剂Ⅱ),原因是 。
某化学小组按下图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。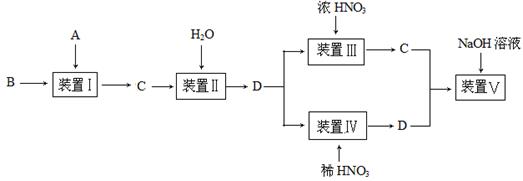
请回答下列问题:
(1)A与B反应的化学方程式是 ;A与B反应迅速,实验中需要采取措施控制气体放出的快慢,则装置Ⅰ所选择的主要仪器为 (不包括铁架台、铁夹、橡皮塞和导管等)。
(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是 。实验室制取CO2气体的化学方程式是 。
(3)装置Ⅱ中发生反应的化学方程式是 。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸 (填“强”或“弱”),判断的依据是 。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要 (填“是”或“否”),理由是 。
如下图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式。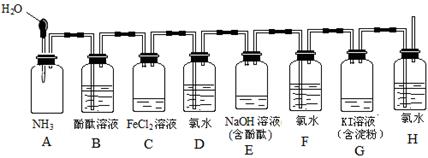
(1)A中的现象为 ,
离子方程式 。
(2)C中的现象为 ,
离子方程式 。
(3)E中的现象为 ,
离子方程式 。
(4)G中的现象为 ,
离子方程式 。
Ⅰ.下列实验操作中,叙述正确的是 (填字母)
| A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏小 |
| B.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 |
| C.分液时,分液漏斗中下层液体从下口放出后再将上层液体从下口放出到另—烧杯 |
| D.做焰色反应的铂丝,用硫酸洗涤后,再在酒精灯火焰上灼烧至无色,才可使用 |
E.向溶液中加盐酸酸化的BaCl2 ,如果产生白色沉淀,则一定有SO
F.证明某盐中含有NH4+的方法是:取该盐加入强碱溶液加热,如果产生使湿润的蓝色石蕊试纸变红的气体,便证明有NH4+
G.使用容量瓶配置一定浓度的溶液时,俯视刻度线定容后所得溶液的浓度偏高
H.用灼烧法鉴别棉织品和毛织品,有焦臭味的是毛织品
Ⅱ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为  .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
利用工厂的废铁屑(含少量Fe2O3、SiO2、锡等),制备绿矾(FeSO4·7H2O)的过程如下:
已知:①室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
②溶液X加KSCN不显红色。
(1)操作I的名称为 ,所需玻璃仪器为_______________。
(2)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(3)操作 II 中,试剂 Y 是_______,然后用稀硫酸将溶液酸化至 pH="2" 的目的是 。
(4)写出绿矾与酸性高锰酸钾溶液反应的离子方程式 。
(5)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至 pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。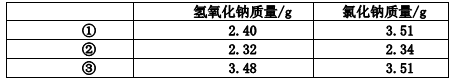
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。