某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是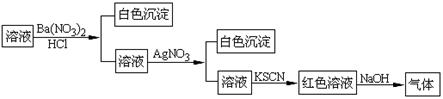
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |
下列实验或生产操作:①蛋白质溶液中加入硫酸铵形成沉淀;②二氧化氮经加压凝成无色液体;③石蜡催化裂化;④碘受热变成碘蒸汽;⑤照相底片被感光。其中,没有新的物质生成的是()
| A.①④ | B.②③ | C.①③⑤ | D.①②④ |
下列叙述中正确的是()
| A.阳离子不一定是金属离子,含阳离子的物质一定含阴离子 |
| B.阴、阳离子相互作用不一定形成离子化合物 |
| C.离子化合物均属于强电解质,都易溶于水 |
| D.由某金属元素的阳离子和某非金属元素阴离子组成的物质一定是纯净物 |
某共价化合物分子中含有C.N、O、H四种元素,且以nC.nN、nO分别表示C.N和O的原子数目,则H原子数目最多为()
A.2nO+2 B.2nC+nN C.2(nC+nN) D.2nC+nN+2
下列化学式及结构式中,从成键情况看来不合理的是()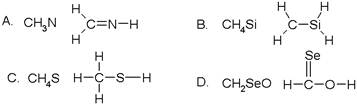
无机化学中也存在同分异构体,互为同分异构体的一组无机物是()
| A.NH4CNO与尿素CO(NH2)2 |
| B.H2O与D2O |
| C.[Cr(H2O)5Cl]Cl2·H2O与[Cr(H2O)4Cl2]Cl·2H2O |
| D.Si(OH) 4与H4SiO4 |