进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9—1.5之间,请问___ 。(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由_ 。
(2)当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐食用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
。 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。
漂白粉常用作消毒剂、杀菌剂、漂白剂等。工业上是把氯气通入含水略少于1 %(质量分数)的消石灰中制得漂白粉。漂白粉是一种混合物,其有效成分是Ca(ClO)2,商品漂白粉中往往含有Ca(OH)2、CaCl2、H2O等杂质。漂白粉质量高低由“有效氯”(过量浓盐酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)和它保持有效氯的时间来决定的。
⑴ 现称取某漂白粉4.00 g配制成500 mL溶液,准确吸取其中25.00 mL后,加入足量的足量浓盐酸和KI溶液,静置。待反应产生的氯气与KI完全反应后,用0.100 mol/L的Na2S2O3溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI),到达终点时消耗20.00 mLNa2S2O3溶液。计算该漂白粉中有效氯的百分含量。
⑵ 某研究性学习小组用上述方法测得一种漂白粉的有效氯为56%。请根据推理和计算判断该实验结果是否准确。
⑶ 某品牌漂白粉的组成可表示为Ca(OH)2·3CaCl(OCl)·nH2O,有效氯为35%,n=。
取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。
已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,甲烷的燃烧热是多少?
(2)现有CO和CH4组成的混合气体共0.75 mol,完全燃烧生成二氧化碳气体和18 g液态水,放出热量为多少?
(3)120 ℃、101 kPa下,a mL由CO和CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为____________(保留2位小数)。
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是__________________。
人民网曾报道,日本事业集团在太空建立巨大的集光装置,把太阳光变为激光用于分解海水制氢: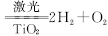 ,下列说法中不正确的是
,下列说法中不正确的是
| A.反应物H2O的总能量高于生成物H2和O2的总能量 |
| B.TiO2可以提高H2O的分解率 |
| C.反应为吸热反应 |
| D.使用氢气作燃料有利于控制温室效应 |
已知反应FeO(s)+CO(g) Fe(s)+CO2(g)的Kc=0.5(1 273 K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
Fe(s)+CO2(g)的Kc=0.5(1 273 K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?